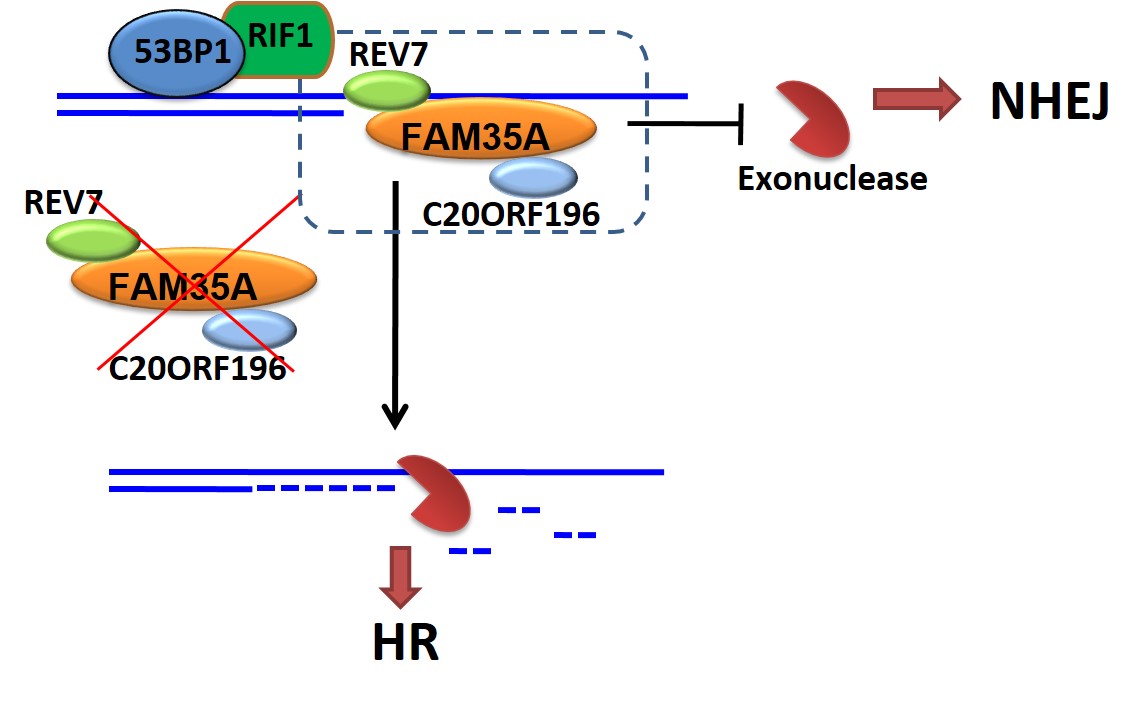
DNA双链断裂(Double-Strand Break,DSB)是最致命的DNA损伤之一。错误的DSB的修复,会导致基因突变、染色体异位或者产生对细胞有害的修复产物。为了避免这些非正常的修复,细胞必须在多种互不兼容的修复途径中,根据细胞所处的细胞周期和DSB的末端状态做出作出正确的选择。这个过程称之为DSB修复途径的选择调控,对于维护基因组的稳定至关重要。DSB主要由非同源末端连接(non-homologous end-joining,NHEJ)和同源重组(homologous recombination, HR)进行修复。在细胞周期中,NHEJ主要发生在G0/G1和G2期。与NHEJ不同,HR发生在细胞周期的S和G2期,是复制相关DSBs的主要修复方式。决定这两条通路的关键步骤是末端剪切(resection)发生与否。末端剪切是进行HR的必需的过程;发生剪切的DNA末端,不能被NHEJ核心蛋白KU70/80识别,因此只能进行HR。该过程由很多因子调控。在前期研究中,我们与合作者已经发现53BP1-RIF1和BRCA1-CtIP形成了一个细胞周期依赖的调控环路,调控DSB修复途径的选择(Mol Cell,2013)。BRCA1-CtIP促进末端剪切,从而促进HR;而53BP1-RIF1抑制末端剪切,从而促进NHEJ。RIF1下游的蛋白及其作用机理一直是研究的热点。直到2015年,有两个研究团队独立鉴定出REV7蛋白参与RIF1下游,促进NHEJ,但分子机制并不清楚。我们通过免疫共沉淀和质谱分析的手段,发现了两个新的REV7结合蛋白,FAM35A和C20orf196。FAM35A含有3个OB-fold结构域,类似于复制相关蛋白RPA1和端粒相关蛋白POT1,可以结合单链DNA。FAM35A和C20orf196参与了DSB修复,拮抗了BRCA1依赖的DNA末端剪切(resection),从而促进NHEJ。我们推测,FAM35A可能与POT1在端粒保护中的功能类似,保护DNA末端。该研究目前于9月25日发表于Nature Communications杂志。另外,有多个组也有类似发现,鉴定或筛选到该蛋白复合物参与NHEJ(Cell 2018; Nature 2018a; Nature 2018b; Nature 2018c; Nat Cell Biol. 2018; EMBO J. 2018a; EMBO J. 2018b).
北京大学生命学院博士生高胜贤和冯素敏为该论文的并列第一作者,徐冬一研究员和郭荣副研究员为该论文的共同通讯作者。该项工作得到了国家自然科学基金委和蛋白质与植物基因研究国家重点实验室的支持。

