2018年7月2日,北京大学生命科学学院细胞增殖与分化教育部重点实验室陶伟课题组在《Nature Communications》杂志上在线发表了题为"TGF-β signaling alters H4K20me3 status via miR-29 and contributes to cellular senescence and cardiac aging"的研究论文。该研究揭示TGF-β/Smad信号通路能够通过调控表观遗传修饰H4K20me3的改变,进而调节哺乳动物细胞衰老和心脏老化的分子机制。
研究发现细胞衰老不仅可以诱导组织、器官和个体衰老以及衰老相关疾病的发生,它还可以抑制肿瘤发生以及促进胚胎发育过程组织的正常形成。在哺乳动物中,关于体内外衰老诱导信号通过何种信号转导来影响表观遗传修饰的编程,进而调节细胞衰老和组织器官老化的相关分子通路机制,目前并不清楚。
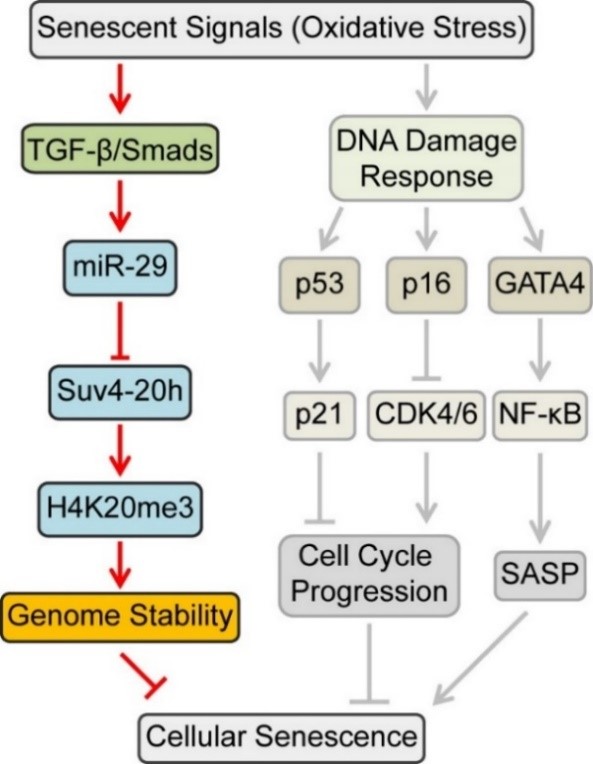
研究发现,在小鼠、大鼠和人的原代成纤维细胞发生衰老的过程中,组蛋白修饰H4K20me3的总体含量及其主要修饰酶Suv4-20h1/h2的表达下降。此后,研究人员发现,miR-29可以通过直接靶定Suv4-20h1/h2的3’ UTR,以抑制它们的表达,进而降低H4K20me3的含量,促进衰老的发生。进一步研究发现,TGF-β/Smad信号通路通过Smad4依赖的方式参与miR-29的转录调控,并促进miR-29的表达。而细胞所处的高氧生存环境诱导了TGF-β/Smad通路的激活,进而引起miR-29的迅速累积,导致H4K20me3整体含量下降。H4K20me3的缺失又导致DNA损伤修复功能缺陷和基因组稳定性的维持能力降低,进而加速细胞衰老进程。此后,研究人员发现,小鼠的增龄过程心脏功能受损,心肌细胞发生衰老,在此过程同时伴随着TGF-β/miR-29信号通路的活化以及H4K20me3的减少;而且在年老小鼠中,用TGF-β/Smad信号通路的特异性抑制剂阻断该通路,可以降低心脏中miR-29的表达,提高H4K20me3的总含量,并缓解心脏功能的损伤程度。该研究不仅揭示了TGF-β/Smad信号通路被环境压力激活后能够通过导致表观遗传修饰状态的改变,调控细胞衰老和心脏老化的分子机制,并且初步探究发现通过应用靶定该通路的小分子抑制剂使其处于失活状态,能够拮抗个体增龄而引发的心脏功能紊乱。
2012级博士研究生吕国良和2014级博士研究生管仪婷为该论文的并列第一作者。北京大学生命科学学院的陶伟教授为该论文的通讯作者。该研究获得北京大学生命学院以及其他院校诸多老师的支持和帮助,在此一并致谢。研究项目获得了北京大学细胞增殖与分化教育部重点实验室、国家科技部973计划以及国家自然科学基金委等基金的支持。

