
图片设计源于“八卦”,在此代表人类来自精子的父源基因组与来自卵细胞的母源基因组在受精后的“阴阳融合”。整幅画面传递着人类受精卵在发育过程中,父源基因组(金色蛇)染色质快速打开并且其开放程度迅速超过母源基因组(红色蛇),并将这一逆转的开放程度不对称状态一直维持到4-细胞胚胎阶段这一含义。
2018年6月18日,北京大学北京未来基因诊断高精尖创新中心、生命科学学院生物动态光学成像中心汤富酬课题组携手北京大学第三医院乔杰课题组合作在国际知名学术期刊《Nature Cell Biology》在线发表了题为"Single-cell Multi-omics Sequencing of Human Early Embryos"的研究论文。利用汤富酬课题组发展的高精度的单细胞多组学测序技术“single-cell COOL-seq”(Cell Research, 2017),首次在单细胞分辨率,解析了人类着床前胚胎发育过程中DNA甲基化组和染色质状态组的重编程过程,以及染色质状态与DNA甲基化之间的相互关系等关键生物学特征。
汤富酬教授课题组和乔杰教授课题组长期紧密合作,致力于人类着床前胚胎发育过程中基因表达的表观遗传学调控机理方面的研究。采用汤富酬课题组发展的单细胞RNA-seq转录组测序技术,于2013年绘制了完整的人类着床前胚胎的高精度单细胞转录组图谱ADDIN EN.CITEADDIN EN.CITE.DATA(Nature Structural & Molecular Biology, 2013);之后利用汤富酬课题组发展的微量细胞DNA甲基化组高通量测序技术,于2014年在国际上首次实现了对人类早期胚胎发育过程中DNA甲基化组重编程的系统研究ADDIN EN.CITEADDIN EN.CITE.DATA(Nature, 2014)。2018年该团队利用单细胞DNA甲基化高通量测序技术,首次在单细胞分辨率深入解析了人类着床前胚胎发育的DNA甲基化组图谱(Nature Genetics, 2018),揭示了人类着床前胚胎的去甲基化重编程,实际上是高度有序的大规模去甲基化和局部的DNA加甲基化动态平衡的结果,并揭示了父母源基因组差异甲基化等特征。
为了进一步在极限分辨率研究染色质状态在DNA甲基化重编程过程中的动态重构过程,该研究利用汤富酬课题组发展的国际领先的单细胞多组学测序技术(single-cell COOL-seq),在单细胞、单碱基分辨率系统地描绘了人类着床前胚胎发育过程中,各个发育阶段表观基因组多个层面的动态变化。对于存在高比例非整倍体的样品(例如人类着床前胚胎、人类癌症样品等),利用少量细胞的表观基因组测序方法,例如ChIP-seq、ATAC-seq、DNase-seq等,得到的结果有可能会被混杂在样品中的异常的非整体细胞所混淆。因此该研究利用汤富酬课题组发展的scCOOL-seq技术,可以在单细胞水平有效地区分整倍体和非整倍体细胞,在排除非整倍体细胞后、利用整倍体胚胎的单细胞数据,更为精准地反映人类着床前胚胎发育过程中表观基因组多层面的动态变化。该研究的主要发现有:
(1)受精后的19个小时以内,高度特化的精子和卵子都经历了大规模的染色质重构过程,来自精子的父源基因组染色质被迅速打开,而来自卵细胞的母源基因组染色质的开放程度降低(精子的平均染色质开放程度为5%,卵子为42%,受精卵为34%)。随后父母源基因组染色质的开放程度同时回落,直至合子基因激活的8-细胞胚胎阶段之后染色质开放程度再次增加,到桑椹胚阶段染色质开放程度达到最高点(2-细胞的平均染色质开放程度为32%, 4-细胞为30%, 8-细胞为27%,桑椹胚时期为40%;图1a)。利用该研究鉴定出的61,403个近端染色质开放区域进行非监督层次聚类分析发现,和小鼠胚胎相似,在人类早期胚胎发育过程中,近端染色质开放区域具有强烈的发育阶段特异性,更重要的是近端染色质开放区域在合子基因激活时期,即4-细胞到8-细胞时期,发生了最剧烈的染色质重构过程,着床前胚胎聚类分为两支,一支是4-细胞阶段之前的胚胎,另外一支是8-细胞阶段之后的胚胎(图1b)。
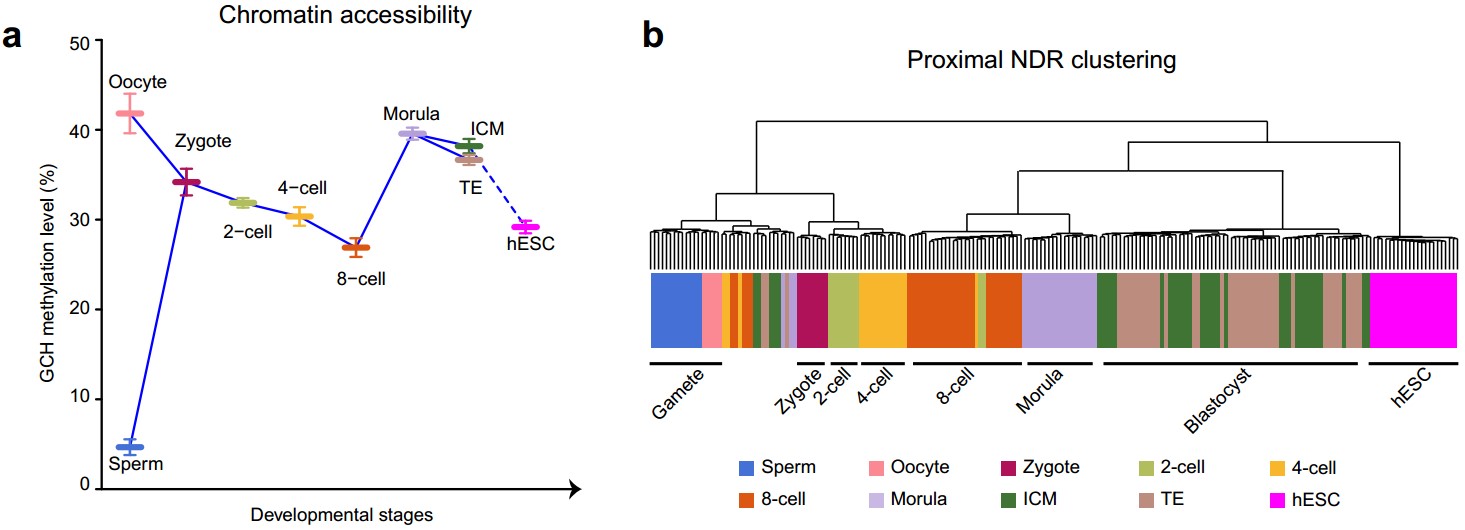
图1:人类着床前胚胎(整倍体胚胎)发育过程中染色质开放程度的动态变化(a)以及近端(基因启动子区域)染色质开放区域的非监督层次聚类分析(b)
(2)首次发现不同于小鼠受精卵,人类受精卵在发育过程中父源基因组染色质快速打开并且其开放程度迅速超过母源基因组,并将这一逆转的父母源基因组染色质开放程度不对称状态一直维持到4-细胞胚胎阶段。该研究首次实现了在人类着床前胚胎的单个细胞内,将父母源基因组信息精确分开并进行DNA甲基化和染色质开放程度的分析(图2a)。在此基础上,该研究发现,人类受精卵在受精后19个小时左右,其父源基因组的染色质已经比母源基因组更为开放,并且这一不对称状态一直维持到4-细胞胚胎阶段才结束(图2b)。这与小鼠中完全不同,小鼠胚胎在受精后很快每个胚胎细胞中其父源基因组染色质的开放程度变得跟母源基因组的一样,并且此后一直维持这种父母源基因组染色质开放程度的对称状态。人类受精卵中父源基因组更快速打开并且开放程度迅速超过母源基因组,这可能更有利于DNA去甲基化酶在父源基因组上的结合,从而加速父源基因组的去甲基化进程以及其他表观遗传学重编程进程。
(3)首次发现不同于小鼠胚胎,人类着床前胚胎具有更为开放、松散的染色质结构。该研究首次实现了对人类与小鼠着床前胚胎父母源基因组染色质开放程度的系统定量比较(图2c)。基于同一技术平台的绝对定量比较,该研究发现与小鼠胚胎相比,在对应的胚胎阶段,人类着床前胚胎具有更开放松散的染色质结构,而这一松散的染色质结构有可能更容易出现基因组不稳定性,进而导致人类着床前胚胎发育到囊胚阶段的比率远低于小鼠(人类胚胎的囊胚发育率只有40-60%,而小鼠胚胎的囊胚发育率高达95%以上)。小鼠胚胎的父源基因组和母源基因组在受精后被迅速打开,之后染色质开放程度回落,到2-细胞时期达到最低点;与此不同,人类胚胎母源基因组在受精后其染色质开放程度即开始下降,至8-细胞阶段降至最低点。而人类胚胎父源基因组在受精后先被迅速打开,之后染色质开放程度逐渐回落,到8-细胞阶段降至最低点。人类和小鼠染色质状态重构模式的差异刚好与这两个物种合子基因激活时间的差异吻合。
(4)首次发现受精后,人类雌性胚胎中父源X染色体迅速去甲基化并被激活,到2-细胞阶段后,父源X染色体的DNA甲基化水平已经远低于母源X染色体,并在此后一直维持这一逆转的不对称性。该研究可以精确地区分雌性和雄性胚胎,并在此基础上系统研究了人类雌性着床前胚胎中父母源X染色体的DNA甲基化和染色质开放程度的差异(图2d)。每个雌性细胞中有两条X染色体,其中一条来自精子(父源X染色体),另外一条来自卵细胞(母源X染色体)。scCOOL-seq技术可以基于杂合单核苷酸多态性(SNP)信息在每个单细胞中精确地区分父母源X染色体。该研究表明,与全基因组的DNA甲基化重编程和染色质状态重构特征一致,受精后,父源X染色体迅速去甲基化并被激活,到2-细胞阶段之后,父源X染色体的DNA甲基化水平已经显著低于母源X染色体的甲基化水平,并在此后一直维持这一不对称状态。与此同时,父源X染色体的染色质状态也迅速变得比母源X染色体更为开放,并一直维持到了4-细胞阶段。
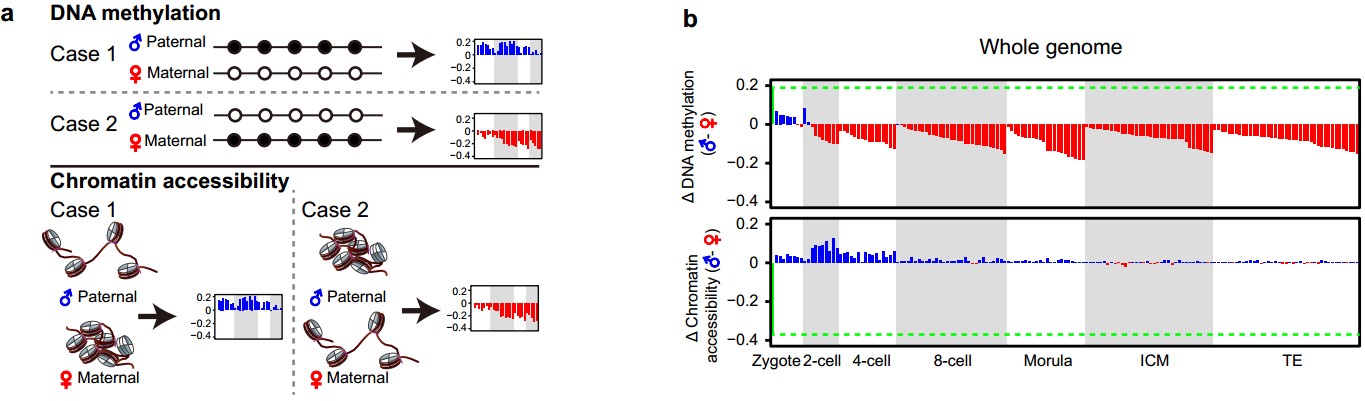
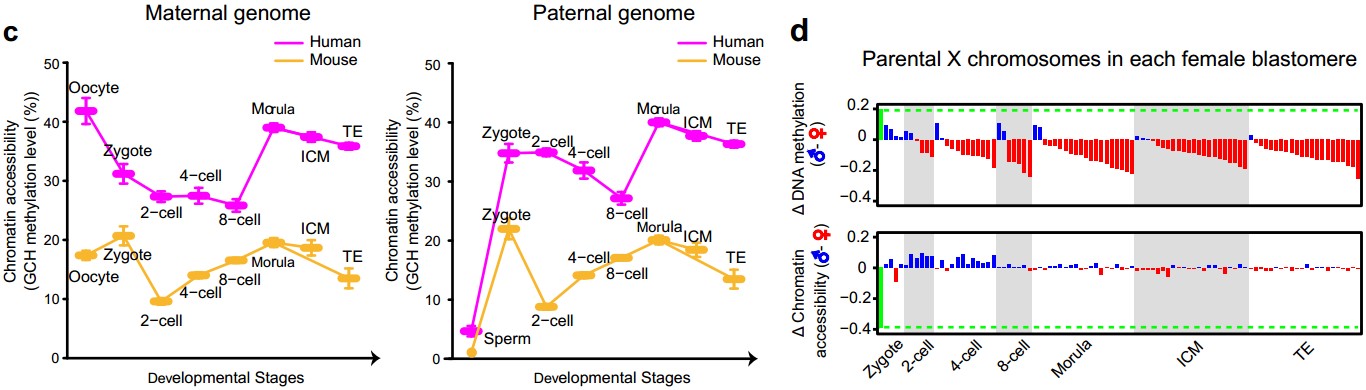
图2:人类着床前胚胎发育过程中父母源基因组DNA甲基化与染色质开放程度的不对称分布(a, b),人鼠物种间父母源基因组染色体开放程度的比较(c)以及单个雌性胚胎细胞中父母源DNA甲基化与染色质开放程度的差异(d)
(5)首次在单细胞分辨率,揭示了人类着床前胚胎发育过程中,各种基因组元件DNA去甲基化和染色质状态重构过程的异步性(图3a,b)。该研究发现,人类着床前胚胎发育过程中,基因启动子区域DNA甲基化异质性强烈的基因和染色质状态异质性强烈的基因是两类不同的基因。例如从4-细胞到桑椹胚阶段,启动子区域染色质状态有强烈异质性的基因其启动子DNA甲基化没有显著的异质性(图3c中I类基因),这些基因主要参与染色体组装、染色质的修饰和细胞周期。这暗示了染色质重构相关基因在这些胚胎时期的一部分细胞中活跃表达,而这种表达异质性主要是由这些基因启动子区域染色质状态的异质性驱动的。从受精卵到囊胚阶段,启动子区域DNA甲基化有强烈异质性的基因其启动子染色质状态没有显著的异质性(图3c中II类基因),这些基因主要参与免疫炎症反应和化学刺激的感知。这暗示了免疫炎症反应和化学刺激相关基因的DNA去甲基化在这些时期的胚胎的一部分细胞中还没有完成。
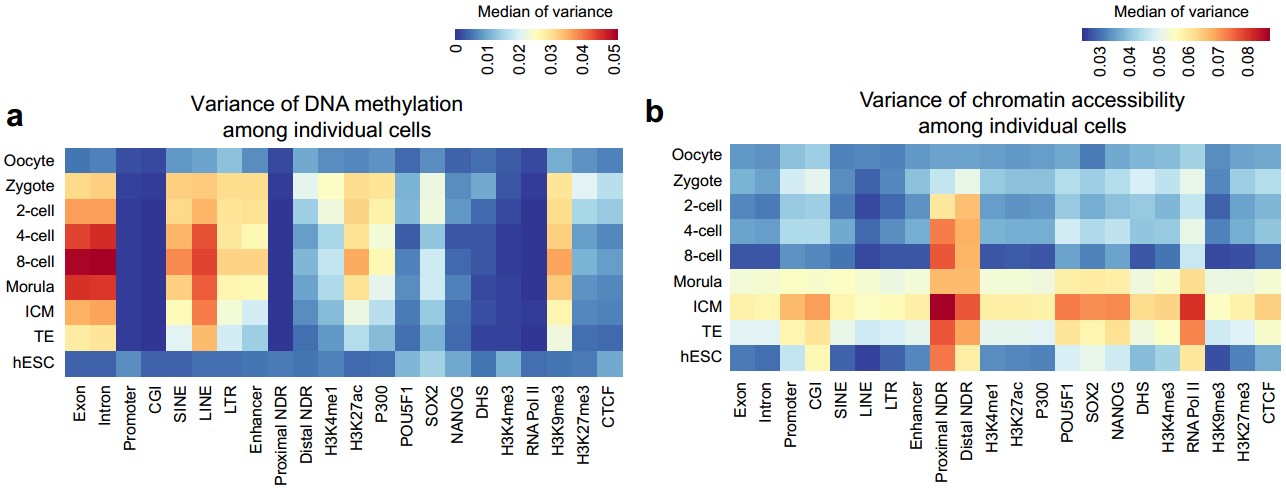
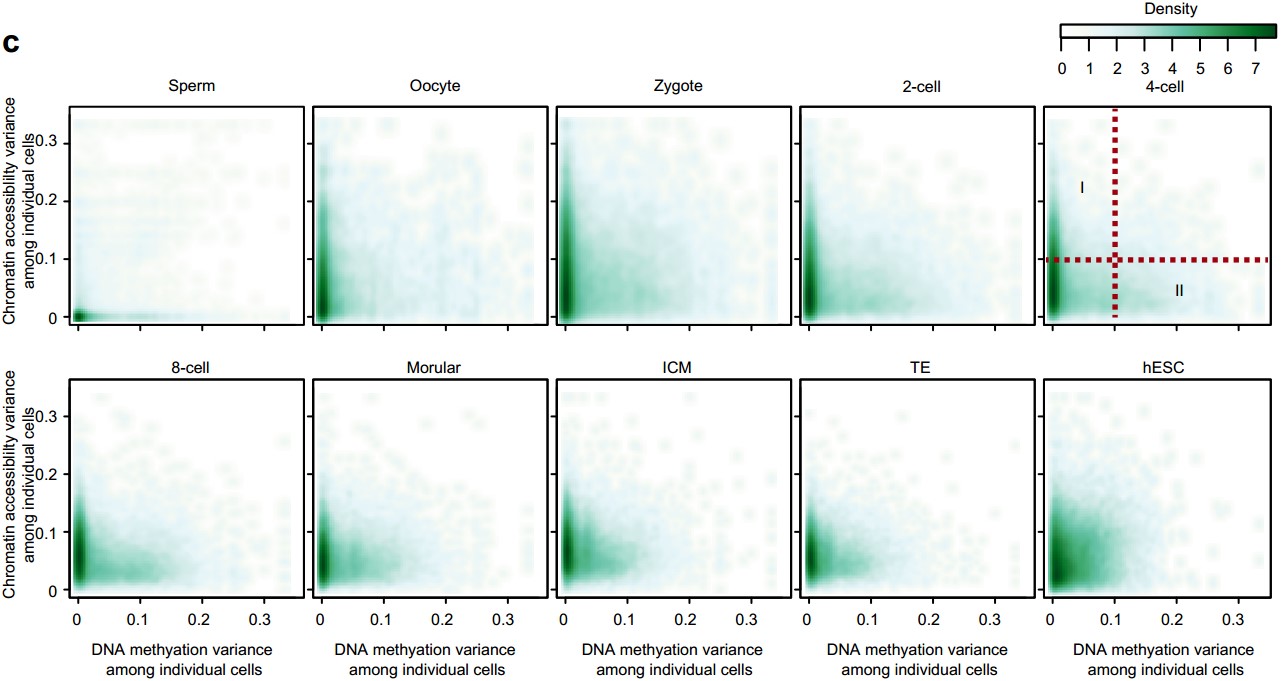
图3:各个元件DNA甲基化异质性(a)和染色质状态异质性(b),以及基因启动子区DNA甲基化异质性和染色质状态异质性的联系(c)
(6)通过转录抑制实验,首次发现,在人类着床前胚胎发育过程中,持续转录对于大量基因维持其启动子区域染色质持续处于开放状态具有重要作用。该研究发现,在人类和小鼠着床前胚胎发育过程中,合子基因激活伴随着启动子区域大片段(长度大于300bp)染色质开放区域比例的大幅度增加(图4)。使用RNA聚合酶抑制剂α-Amanitin处理受精卵、广谱抑制其转录活动,这些胚胎发育到8-细胞阶段时1700多个(35%)基因会失去启动子区域的染色质开放状态。这些依赖于持续转录的启动子大片段染色质开放区域对应的基因,很多都在胚胎发育过程中发挥重要作用,这说明持续转录对于维持大量胚胎发育重要基因启动子区域持续处于开放状态起了关键作用。
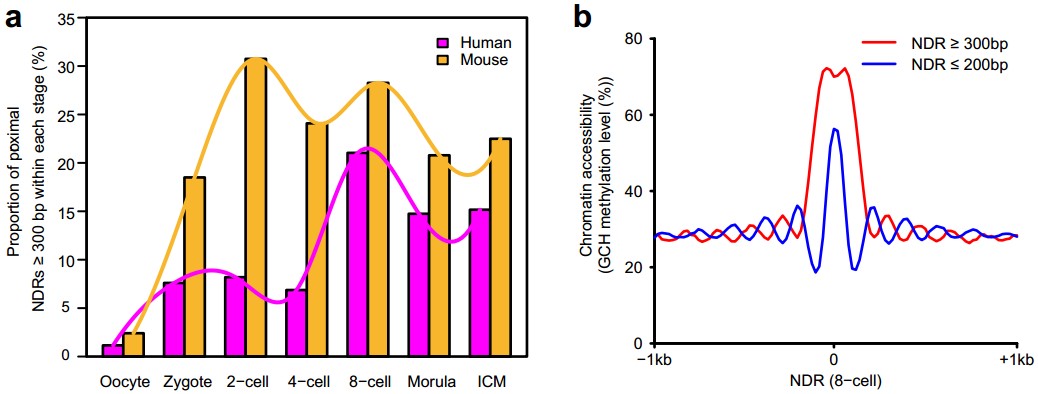

图4:持续转录对于染色质开放状态的维持是必须的
(7)对人类着床前胚胎进行了大规模的基因组调控区域预测,共得到37000多个候选增强子区域。利用scCOOL-seq数据,该研究结合染色质开放程度和DNA甲基化信息,进行了人类和小鼠的候选增强子预测。该研究发现对于人类和小鼠着床前胚胎中的染色质处于开放状态的候选增强子,只有700多个是在这两个物种中同时处于染色质开放状态,说明在着床前胚胎发育过程中处于活跃状态的增强子具有很强的物种特异性。与此同时,该研究对人类着床前胚胎中鉴定出的接近40万个染色质开放区域(NDR)进行了转录因子结合富集分析,发现相对于滋养外胚层细胞,多能性的内细胞团细胞中的远端(距离基因转录起始位点2kb以外)染色质开放区域更富集转录因子ZNF281的结合序列;而相对于内细胞团细胞,滋养外胚层细胞中的远端染色质开放区域更富集转录因子CDX2、TFAP2C(AP2γ)的结合序列,这为今后研究人类着床前胚胎发育过程中转录因子调控下游基因的表达提供了基础。
该研究利用国际领先的单细胞多组学高通量测序技术,深度解析了人类着床前胚胎发育过程中,单个整倍体细胞中DNA甲基化组重编程伴随的染色质状态的重构过程,并系统地研究了人类胚胎父母源基因组在单个细胞中DNA甲基化与染色质开放程度的不对称分布。首次定量比较了人类和小鼠胚胎中父母源基因组的染色质开放程度,发现了人类胚胎不同于小鼠胚胎的物种特异性的关键表观遗传学特征,例如:与小鼠胚胎相比,人类着床前胚胎的染色质状态更为松散;不同于小鼠胚胎,人类着床前胚胎中父源基因组染色质状态在卵裂阶段早期比母源基因组更为开放。这为今后人们继续研究人、鼠两个物种早期胚胎中表观遗传学的异同提供了理论基础,明确了利用小鼠作为模式生物研究哺乳动物早期胚胎发育的优势和局限性。同时为研究非整倍体等发育异常的胚胎、以及相关的反复流产等临床医学问题提供了新思路和新研究手段。
北京大学北京未来基因诊断高精尖创新中心博士生李琳、博士生高云,四川大学研究员郭帆,以及北京大学第三医院博士生任一昕为该论文的并列第一作者;汤富酬教授和乔杰教授为该论文的共同通讯作者。该项目得到了国家自然科学基金、国家重大科学研究计划、北京市科学技术委员会、北京未来基因诊断高精尖创新中心(ICG)、生命科学联合中心(CLS)等的资助。
原文链接:https://www.nature.com/articles/s41556-018-0123-2
参考文献:
ADDIN EN.REFLISTGuo, F., Li, L., Li, J., Wu, X., Hu, B., Zhu, P., Wen, L., and Tang, F. (2017). Single-cell multi-omics sequencing of mouse early embryos and embryonic stem cells. Cell research.
Yan, L., Yang, M., Guo, H., Yang, L., Wu, J., Li, R., Liu, P., Lian, Y., Zheng, X., Yan, J., et al.(2013). Single-cell RNA-Seq profiling of human preimplantation embryos and embryonic stem cells. Nat Struct Mol Biol20, 1131-1139.
Guo, H., Zhu, P., Yan, L., Li, R., Hu, B., Lian, Y., Yan, J., Ren, X., Lin, S., Li, J., et al.(2014). The DNA methylation landscape of human early embryos. Nature511, 606-610.
Zhu, P., Guo, H., Ren, Y., Hou, Y., Dong, J., Li, R., Lian, Y., Fan, X., Hu, B., Gao, Y., et al.(2018). Single-cell DNA methylome sequencing of human preimplantation embryos. Nature genetics.

